


诺华以240亿美元居全球药企收入榜首
6月14日,诺华成为2021年最赚钱的制药公司,击败了辉瑞和强生;Moderna、BioNTech和再生元这几家从事新冠产品销售的药企也获得巨额收益,跻身净收入排名前10。2021年,诺华的净利润从2020年的80.7亿美元飙升至240.2亿美元。诺华在2021年从剥离资产交易中受益,该公司以约207亿美元的价格出售了5330万股罗氏股票,净收入增加了146亿美元。
神州细胞2价新冠疫苗I期临床结果积极
神州细胞6月16日公告,近日,公司控股子公司神州细胞工程有限公司自主研发的重组新冠病毒Alpha+Beta变异株S三聚体蛋白疫苗(项目代号:SCTV01C)已进行国内I期临床试验的期中分析并取得积极结果,详细数据拟于近期提交相关科学期刊发表。

《猴痘诊疗指南(2022年版)》发布
国家卫健委印发《猴痘诊疗指南(2022年版)》,要求各级卫生健康行政部门、中医药管理部门要高度重视,认真组织做好猴痘诊疗相关培训,切实提高“四早”能力,一旦发现猴痘疑似病例或确诊病例,应及时按照有关要求报告,并全力组织做好医疗救治工作,切实保障人民群众生命安全和身体健康。
《不明原因儿童严重急性肝炎诊疗指南》发布
6月16日,国家卫健委办公厅印发《不明原因儿童严重急性肝炎诊疗指南(试行)》,内容介绍了儿童严重急性肝炎的病因和发病机制、临床表现和治疗措施等九个版块。

Moderna公司奥密克戎疫苗临床结果公布
近日,Moderna公布了第一个含有奥密克戎疫苗的新一代新冠疫苗的临床试验结果。这款疫苗是包含Moderna原始疫苗mRNA-1273和一种针对奥密克戎候选疫苗的结合体,是一种改良版的mRNA新冠疫苗。Moderna预计,与原始疫苗mRNA-1273相比,mRNA-1273.214诱导的中和抗体滴度随着时间的推移对奥密克戎的耐受性会更强。根据这一试验结果,Moderna表示将在未来几周内向美国卫生监管机构提交这项研究的初步数据,并希望能在今年夏末推出这种改良版疫苗加强针。
诺瓦瓦克斯医药新冠疫苗加强针在澳获批
近日,诺瓦瓦克斯医药新冠疫苗Nuvaxovid已获得澳大利亚药品管理局(TGA)临时批准,作为用于18岁及以上成年人的加强针疫苗。据悉,在今年1月份,该疫苗首次在澳大利亚获得批准。该机构称,临时批准是基于该公司在澳大利亚进行的第二阶段试验数据,试验表明,该疫苗加强针产生了与第三阶段试验相同或更好的免疫反应。
研究发现1000多个新冠重症相关基因
6月16日,英国谢菲尔德大学和美国斯坦福大学医学院的研究人员使用机器学习,确定了1000多个与新冠危重症状发展相关的基因。研究团队还识别出这些基因在其中起作用的特定类型的细胞。这是将新冠病毒相关基因与特定生物学功能联系起来的首批研究之一。相关论文发表在14日的《细胞系统》杂志上。

企业布局
贝达药业拟向实控人定增募资不超10亿元
6月13日,贝达药业公告,拟向公司实际控制人丁列明非公开发行股票数量不超过25,967,281股(含本数),发行价格为38.51元/股,预计募资总额不超过10亿元(含本数),扣除发行费用后将全部用于贝达药业(嵊州)创新药产业化基地项目及补充流动资金。本次发行完成后发行对象认购的公司本次发行的股份自发行结束之日起18个月内不得转让。
企业合作
两家新锐公司就现货型细胞疗法达成合作
日前,专注于开发现货型免疫癌症疗法的Umoja Biopharma与致力于开发诱导多能干细胞(iPSC)疗法的TreeFrog Therapeutics联合宣布两方达成合作。两家公司将尝试将Umoja的iPSC平台与TreeFrog的C-Stem技术结合,以在生物反应器内大规模扩增iPSC细胞与进行免疫细胞分化。
药明生基与Wugen就新型免疫细胞疗法合作
6月16日,药明生基宣布与Wugen就新型免疫细胞疗法WU-NK-101达成生产合作,该疗法能够利用免疫记忆的自然杀伤细胞来治疗肿瘤。WU-NK-101是Wugen 公司专有Moneta™平台上开发的第一个项目。该项目旨在利用免疫记忆NK细胞的超能、长效抗肿瘤能力,商业化大规模生产新一代、“现货型”肿瘤免疫治疗性细胞。
人事变动
万春医药宣布多位董事会成员变动
6月13日,美股上市公司万春医药(BYSI.US)发布公告称,Daniel L.Zabrowski向公司发出通知,表示有意辞去公司董事会和董事会薪酬委员会的职务,并立即生效。同日,Jeffrey Vacirca和Mark Santos也向公司发出通知,表示他们打算辞去董事会职务,并立即生效。
赛生药业:毛力已获委任为副总裁
6月13日,赛生药业宣布,由2022年6月13日起,毛力已获委任为公司副总裁、研发部总经理兼首席医学官("首席医学官")。彼将全面负责集团的研发及医学工作。毛力为上呼吸消化道恶性肿瘤方面的世界知名医生及科学家,于中国及美国拥有逾35年丰富的肿瘤学临床实践、临床和基础研究以及领导经验。
歌里首席商务官尘埃落定
6月13日,歌礼制药宣布前第一三共(Daiichi Sankyo)北美总裁兼首席执行官John P. Gargiulo先生已于近期加入歌礼管理团队,出任首席商务官。John P. Gargiulo先生将领导歌礼的业务拓展及战略合作,并向歌礼创始人、董事会主席兼首席执行官吴劲梓博士汇报工作。
心血管专家Krishna Sudhir博士加入帕母医疗
近日,帕母医疗宣布Krishna Sudhir博士正式加入帕母医疗科学顾问委员会(Scientific Advisory Board)。Krishna Sudhir博士将为帕母医疗的技术平台和研发管线布局提供科学指导,协力推动创新技术孵化及产品国际化进程,助力中国原创技术走向全球。

百时美施贵宝红细胞成熟剂利布洛泽®在国内上市
6月14日,百时美施贵宝宣布,全球首个且目前唯一红细胞成熟剂利布洛泽®(通用名“注射用罗特西普”)正式在国内上市。作为十余年来国内首个治疗β-地中海贫血(后称‘β-地贫’)的创新药物,利布洛泽®将用于治疗需要定期输注红细胞且红细胞输注≤15单位1/24周的β-地中海贫血成人患者。
Amylyx治疗ALS药物获加拿大有条件批准
日前,加拿大卫生部宣布有条件地批准了Amylyx Pharmaceuticals旗下肌萎缩侧索硬化(ALS)药物Albrioza(AMX0035),这也是该公司在全世界首次获得批准,Albrioza也成为了加拿大第一个获批的ALS药物。
FDA批准Alnylam公司RNAi疗法Amvuttra上市
6月13日,Alnylam宣布,FDA批准该公司RNAi疗法Amvuttra(vutrisiran)上市,用于治疗成人遗传性转甲状腺素蛋白介导(hATTR)的淀粉样变性多发性神经病变。这是FDA批准的首款只需每3个月皮下注射一次,就能够逆转神经病变损伤的RNAi疗法。
海曲泊帕乙醇胺片获美国FDA孤儿药资格认定
近日,恒瑞医药创新药海曲泊帕乙醇胺片(商品名:恒曲®)用于恶性肿瘤化疗所致血小板减少症适应症(CIT)获得美国食品药品监督管理局(简称“FDA”)授予的孤儿药资格认定。本次获得美国FDA孤儿药资格认定后,海曲泊帕乙醇胺片临床试验及上市注册的进度将加速推进。海曲泊帕乙醇胺片是恒瑞医药自主研发的1类新药,为小分子、口服、非肽类促血小板生成素受体(TPO-R)激动剂,获国家十二五重大专项支持。
EarliTec公司核心产品EarliPoint获得FDA 510(k)认证
近日,EarliTec Diagnostics宣布EarliPoint评估获得美国FDA的510(k)认证,用于评估16-30个月儿童的自闭症谱系障碍。ASD是一种常见的神经发育疾病。EarliPoint评估可以帮助早期识别ASD,并提供与社会残疾水平以及语言和非语言能力相关的EarliPoint严重性指数。EarliPoint评估为患者提供了客观的诊断工具。
武田创新药物Obizur上市申请获得CDE受理
6月16日,武田中国宣布,旗下创新药物重组抗血友病因子(猪序列)Obizur(Susoctocog alfa)上市许可申请正式获得CDE受理。获得性血友病A是一种获得性出血性疾病。Obizur与人序列凝血因子Ⅷ结构相似、序列同源,且不易受到抗人FⅧ自身抗体的灭活,可以替代人FⅧ发挥明显的止血作用。

单抗/双抗
长春高新注射用金纳单抗临床试验获FDA批准
6月14日,长春高新公告,控股子公司金赛药业收到美国FDA关于注射用金纳单抗用于成人斯蒂尔病(AOSD)的临床许可的函。注射用金纳单抗是一种抗白介素 1-β全人源单克隆抗体,适应症为急性痛风性关节炎、全身型幼年特发性关节炎。
荣昌生物抗PD-L1抗体联合ADC疗法获批临床
6月14日,荣昌生物宣布,其在研抗PD-L1抗体RC98联合抗体偶联药物(ADC)维迪西妥单抗治疗实体瘤的临床试验申请,已获得中国国家药品监督管理局(NMPA)批准。此前,维迪西妥单抗联合RC98治疗HER2表达局部晚期或转移性胃癌(包括胃食管结合部腺癌)适应症已获批临床。
凡恩世生物双特异性抗体PT886获批开展临床试验
6月15日,凡恩世生物宣布,其在研产品Claudin18.2/CD47双特异性抗体PT886已获得美国FDA临床试验批准,将在胃癌、胃食管交界处癌和胰腺癌患者中开展1期临床试验。
罗氏Aβ单抗crenezumab临床再次失败
6月16日,罗氏和班纳老年痴呆症研究所联合宣布,crenezumab在阿尔茨海默症预防倡议项目中的II期临床未达到主要研究终点。结果显示,在认知能力或情景记忆功能变化两个共同主要终点方面,该试验未显示出具有统计学意义的临床获益。
复星医药:子公司单抗HLX14启动III期临床试验
6月17日,复星医药公告,控股子公司复宏汉霖自主研发的重组抗RANKL全人单克隆抗体注射液(即HLX14)就用于高危骨折风险的女性绝经后骨质疏松症治疗于中国境内(不包括港澳台地区)启动III期临床试验。该新药为集团自主研发的地舒单抗生物类似药。
赛诺菲抗CD38单抗皮下注射剂型在中国申报临床
6月17日,CDE官网最新公示,赛诺菲递交了isatuximab注射液(皮下注射)的临床试验申请。公开资料显示,isatuximab是一款抗CD38单克隆抗体,此前已获得多个国家和地区监管机构批准,用于静脉给药治疗某些复发性多发性骨髓瘤(MM)患者。
先进疗法
驯鹿生物/信达生物公布BCMA CAR-T最新研究结果
6月13日,驯鹿生物与信达生物共同宣布全人源自体B细胞成熟抗原(BMCA)嵌合抗原受体自体T细胞(CAR-T)疗法的最新1/2期注册性临床研究结果。研究显示,伊基仑赛注射液拥有优异且可控的安全性:79例受试者中,94.9%(75/79)受试者发生细胞因子释放综合征(CRS),均为1~2级CRS,无3级及以上CRS。CRS发生的中位时间为回输后第6.0天,CRS的中位持续时间为5.0天。仅2.5%(2/79)受试者出现免疫效应细胞相关神经毒性综合征(ICANS),其中1级和2级各1例。所有受试者的CRS和ICANS均得到缓解。
阿斯利康AZD8205临床试验申请获得批准
6月14日,CDE官网显示,阿斯利康AZD8205的临床试验申请获批准,用于治疗晚期或转移性实体恶性肿瘤。这是继翰森制药HS-20089后,国内第2家获批临床的B7-H4抗体偶联药物(ADC)。
艾力斯启动伏美替尼治疗转移性非小细胞肺癌临床
据 Insight 数据库显示,近日艾力斯已经登记启动了伏美替尼治疗 EGFR 20 外显子插入突变局部晚期或转移性非小细胞肺癌(NSCLC)的 II 期临床。伏美替尼此前已经在 Ib 期临床中针对 EGFR 20 号外显子插入突变 NSCLC 患者表现出初步疗效,今年 5 月 6 日刚刚以该项适应症被 CDE 纳入突破性疗法程序中。
Seres公司SER-109开放标签试验临床结果公布
Seres Therapeutics近日宣布其ECOSPOR IV临床试验的结果。ECOSPOR IV是SER-109的开放标签试验。SER-109是一种避免艰难梭菌重复感染(rCDI)的在研口服性微生物疗法。长达24周的ECOSPOR IV试验结果显示,SER-109具有良好的耐受性,这与在之前以安慰剂为对照组的ECOSPOR III试验结果一致。
第一三共准疗法组合达到3期临床终点
日前,第一三共(Daiichi Sankyo)公布了FLT3抑制剂quizartinib治疗携带FLT3-ITD突变的急性髓系白血病(AML)患者的3期临床试验结果。与标准治疗对照相比,接受quizartinib联合标准诱导和巩固化疗治疗,然后继续接受quizartinib单药治疗患者的中位总生存期达到31.9个月,是对照组(15.1个月)的两倍以上。
诺华发布Kymriah疗法治疗R/R B-ALL临床追踪结果
诺华近日宣布其Kymriah疗法在ELIANA关键临床试验的5年长期追踪结果。ELIANA试验旨在检测Kymriah用于治疗患有复发性/难治性B细胞急性淋巴细胞白血病(R/R B-ALL)的孩童和年轻成人上的疗效。在ELIANA试验当中以Kymriah疗法治疗的79位病患,其5年总生存率(OS)为55%(95% CI:43-66),而5年无事件生存率(EFS)则为42%(95% CI:29-54)。试验长期追踪结果显示有82%(95% CI:72-90)的病患出现缓解。
辉瑞新冠口服药Paxlovid一项II/III期临床失败
6月15日,辉瑞公布了新冠口服药Paxlovid针对未接种疫苗的成年人以及具有一种或多种进展为重症疾病风险因素的已接种疫苗成年人的II/III期临床(EPIC-SR)研究结果,未达到所有症状连续4天持续缓解的主要终点,次要终点不具有统计学意义。
创新蛋白降解药物已完成首位病患给药
6月16日,Kymera Therapeutics宣布,其创新蛋白降解药物KT-333与KT-413均已完成首位病患给药,开始了临床1期试验。KT-333与KT-413是新颖的蛋白降解小分子药物,分别可降解STAT3与IRAK4蛋白。
智飞生物四价流感病毒疫苗III期临床结果发布
6月16日,智飞生物公告,近日接到全资子公司安徽智飞龙科马生物制药有限公司的上报,获悉其研发的四价流感病毒裂解疫苗获得了Ⅲ期临床试验总结报告。试验结论为该疫苗具有良好的免疫原性及安全性,全面达到临床试验预设目标,在安全性和有效性方面均非劣效于对照疫苗,且符合《季节性流感病毒疫苗临床研究技术指导原则》中有效性与安全性评价的设计要求。
康弘药业盐酸卡利拉嗪胶囊获批临床
6月16日,康弘药业公告,公司近日收到NMPA签发的关于盐酸卡利拉嗪胶囊的《药物临床试验批准通知书》,同意开展临床试验,据介绍,本品用于治疗成人精神分裂症,2015年在美国批准上市,2017年7月,在欧盟获批上市。截止目前,尚未在中国获批上市。
科伦药业激动剂KL340399注射液获批临床
6月16日,科伦药业发布公告称,其控股子公司科伦博泰开发的新一代小分子STING激动剂KL340399注射液获得NMPA批准,开展瘤内注射治疗晚期实体瘤的临床试验。STING全称干扰素基因刺激蛋白,是一种跨膜蛋白,具有识别病毒和细菌感染以及启动机体固有防御和免疫反应的作用。
新型抗肿瘤药物在中国启动3期临床
国药物临床试验登记与信息公示平台显示,Nanobiotix公司和联拓生物已启动一项NBTXR3治疗老年局部晚期头颈部鳞状细胞癌患者的国际多中心3期(关键性阶段)研究。公开资料显示,NBTXR3是Nanobiotix公司开发的一款潜在“first-in-class”的新型放射增敏剂,联拓生物于2021年5月通过一项超2亿美元的合作获得了在大中华区开发商业化该产品的独家授权。

罗氏2022Q1财报:诊断业务表现优越
近日,罗氏公布2021年第一季度业绩。财报显示,罗氏Q1整体业绩下降1%,去除汇率因素整体业绩上升3%;其中,诊断试剂板块营收增长50%,制药板块下降14%。具体产品上:整体表现与2020年相似,老药中仅有IL-6单抗Actemra/RoActemra(托珠单抗)实现销量增长。Avastin在本季度的销售额锐减42%,至8.63亿瑞士法郎;Herceptin同比下降37%,至7.55亿瑞士法郎;利妥昔单抗的销售额下降了近一半,至7.05亿瑞士法郎。
雅培2022Q1财报:业绩斐然,净利润同比增长200%
近日,雅培公布2021年第一季度业绩。财报显示,Q1净销售额为104.56亿美元,同比增长35.3%;净利润为17.93亿美元,同比增长217.8%。按业务划分,营养业务销售额为20.36亿美元,同比增长6.9%;诊断业务销售额为40.14亿美元,同比增长119.8%;制药业务销售额为10.70亿美元,同比增长2.5%;医疗器械业务销售额为33.20亿美元,同比增长13.1%。

ImCheck公司完成9600万欧元融资
6月14日,ImCheck Therapeutics宣布完成9600万欧元的融资。获得资金将用于支持其主打在研疗法ICT01治疗实体瘤和血液癌症的2a期临床试验,以及评估ICT01与PD-1抑制剂联用,治疗多种实体瘤的临床试验。ICT01是一款选择性激活γ9δ2 T细胞的单克隆抗体疗法,靶向嗜乳脂蛋白家族成员BTN3A。
Dren Bio公司完成6500万美元B轮融资
Dren Bio今日宣布完成6500万美元的B轮融资。此次融资使得Dren Bio至今的融资总额达到1.56亿美元。获得的资金使Dren Bio能够在接下来的几个季度里,达成其药物开发项目上许多重要的转折点。Dren Bio主要专注于开发针对癌症、自体免疫等严重疾病的治疗性抗体。
Peptone公司完成4000万美元的A轮融资
日前,Peptone宣布完成4000万美元的A轮融资。这项融资将用于支持Peptone以人工智能方式大规模解析那些悬而未解、复杂、极具挑战的内在无序蛋白结构。在人体内大约有一半的蛋白质,其序列中的一部分无法折叠成固定的结构,因此这部分结构无法通过已知的基因序列准确地预测出来。
波士顿科学以约2.3亿美元收购M.I.Tech公司约64%股权
6月16日,波士顿科学宣布已与Synergy Innovation达成一项交易,以约2.3亿美元收购后者持有的医疗设备开发和制造公司M.I.Tech约64%的股权。
Third Rock Ventures公司完成11亿美元基金VI资金募集
6月16日,Third Rock Ventures宣布,完成11亿美元Third Rock Ventures基金VI的资金募集。募集基金将用作后续资本支持公司的持续成长以及对广泛生物技术生态系统中与该公司宗旨和策略相符的突破性公司进行投资。

智云健康通过港交所聆讯
据港交所文件显示,6月13日,智云健康通过港交所上市聆讯,摩根士丹利和摩根大通为联席保荐人,其2021年收入17.57亿元,增速109%。智云健康通过为医疗价值链上的所有主要参与者(包括医院、药店、制药公司、患者和医生)提供解决方案,期望引领中国数字化慢病管理市场。
力品药业拟科创板IPO
6月15日,力品药业披露招股说明书,本次发行的股票数量不超过约1.37亿股,公开发行股份数量不超过本次发行后总股本的25%,不低于本次发行后总股本的10%。本次募集资金用于项目及拟投入的募资金额为:产业化基地建设项目,拟投入募集资金3亿元;改良型新药制剂的研发项目,拟投入募集资金6亿元;补充流动资金项目,拟投入募集资金3亿元。
来凯医药递表港交所主板
6月16日,来凯医药有限公司向港交所主板提交上市申请,中金公司为独家保荐人。来凯医药为生物科技公司,致力于癌症及肝纤维化等疾病的治疗。旗下两款核心产品可用于治疗前列腺癌、乳腺癌、卵巢癌等。

我国生物医药研发支出环比增长
随着医改的稳步推进,传统的以销售为主的扩张模式难以为继,国内药企面临创新转型。2016-2020年,生物医药上市公司研发投入不断扩大。2020年,我国生物医药上市公司的研发支出达到115.34亿元,同比上升37.10%。2021年上半年,我国生物医药上市公司研发支出已经达到69.78亿元,全年研发支出有望进一步增长。整体来看,研发投入力度的加大一定程度上有助于加快企业在生物医药产品研究成果转化。

我国生物医药新产品研发活跃
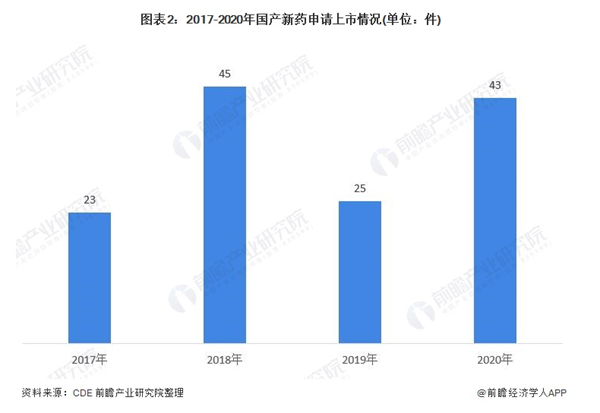
从转化成果来看,我国新药上市情况乐观,2017-2020年,国产新药申请上市数量呈波动变化趋势,其中2018年达到峰值45件。2019年,药审中心受理国产Ⅰ类创新药上市申请25件(16个品种),2020年上市申请43件。

从学术到产业,更多定制化产业周刊(全球产业舆情监测、前沿技术情报追踪、产融政策权威解读、产业招商精准线索),敬请拨打400-068-7188。同时前瞻产业研究院还提供产业大数据、产业研究、政策研究、产业链咨询、产业图谱、产业规划、园区规划、产业招商引资、IPO募投可研、IPO业务与技术撰写、IPO工作底稿咨询等解决方案。
品牌、内容合作请点这里:寻求合作 ››


 让您成为更懂趋势的人
让您成为更懂趋势的人
想看更多前瞻的文章?扫描右侧二维码,还可以获得以下福利:

下载APP

关注微信号


扫一扫下载APP
与资深行业研究员/经济学家互动交流让您成为更懂趋势的人
违法和不良信息举报电话:400-068-7188 举报邮箱:service@qianzhan.com 在线反馈/投诉 中国互联网联合辟谣平台
Copyright © 1998-2026 深圳前瞻资讯股份有限公司 All rights reserved. 粤ICP备11021828号-2 增值电信业务经营许可证:粤B2-20130734