


启明医疗赴港IPO:心脏瓣膜独角兽 获6次融资和379项专利
继8月4日蓝帆医疗收购瑞士心脏瓣膜企业NVT后,又一家心脏瓣膜领域的企业实现突围。
8月6日,启明医疗向港交所提交了IPO招股书。招股书显示,此次港股申报的联席保荐人为中金公司、高盛(亚洲)、瑞士证券及招商证券。几经辗转,启明医疗的上市之路似乎终于有了定局。

根据招股书,目前启明医疗第一大股东为Horizon Binjiang LLC,持股15.985%;第二大股东Ming Zhi Investments(BVI)Limited持股比例为15.7104%;第三大股东为自然人訾振军,持股比例为10.3077%。
2006年,启明医疗创始团队开启了经导管瓣膜治疗领域研发征程,3年后公司正式成立。
过去数年内,启明医疗获得了众多成就,它曾凭借“新型生物心脏主动脉瓣膜项目”获得全国生物医药行业总冠军,也是国内第一家进入CFDA临床许可的介入式瓣膜企业。
查阅公开资料发现,启明医疗此前至少已完成6轮融资,不乏启明创投、红杉中国以及高盛等大腕的力捧。事实上,融资丰厚的它,出手收购和产品线也是不遗余力。
在全球范围内,启明医疗所属的TAVR(经导管主动脉瓣置换术)领域保持着持续高速的增长。目前,启明医疗研发的全球第一款自膨式肺动脉瓣膜——VenusP-Valve已在近20个国家和地区的27家医疗中心完成178例植入。
招股书显示,启明医疗此次拟募资3亿-5亿美元,用途为VenusA-Valve、VenusA-Plus、VenusP-Valve正进行的研发或计划的商业化提供资金,以及为有关收购Keystone的代价付款及其他交易开支提供资金。
无论本次上港是否成功,启明医疗早已壁垒高筑。在技术方面,启明医疗总计拥有379项专利及专利申请,其中包括中国范围内的81项已经公告的专利及70项专利申请。而在美国、欧盟等主要的海外市场,启明医疗拥有96项已公告的专利以及132项专利申请。

两部门发布《定制式医疗器械监督管理规定(试行)的公告》
2019年7月,国家药监局、国家卫生健康委发布了《定制式医疗器械监督管理规定(试行)的公告(2019年第53号) 》,自2020年1月1日起正式施行。作为首部对定制式医疗器械进行统一监管的法规,《规定》对定制式医疗器械备案管理、设计加工、使用管理、监督管理等作出明确要求。《规定》的出台与临床实际需求直接相关,没有定制式医疗器械,临床上一些特殊治疗需求无法得到满足。此前由于国内并无相关法规,临床所需定制式医疗器械多由医疗机构以临床研究名义,得到伦理委员会批准后,与有条件的医疗器械生产企业合作开发。显然,《规定》的出台为规范定制式医疗器械生产、使用,更好满足临床需求提供了有力保障。
国家药监局再取消16项证明事项 含药品医疗器械等
近日,国家药监局发布《关于取消16项证明事项的公告》,决定继4月首次取消36项证明事项后,今年第二次取消部分证明事项。国家药监局这次取消的16项证明事项,范围涵盖了药品、医药产品、医疗器械、特殊化妆品等。其中,有3项化妆品证明事项改为网络核查,9项药品证明事项改为内部核查,4项医疗器械申请不再要求申请人提交组织机构代码证。具体来说,包括了中药品种保护申请所需的药品批准证明文件、药品生产许可证、药品GMP证书,药品临时进口申请所需再注册受理通知单,港澳台医药产品临时进口申请所需相关文件等。在取消这些证明事项后,药监部门将不再要求办事的申请人提交,而改为进行内部核查。
广东省取消器械检验报告类型和生物学试验检测机构限定
广东省医疗器械技术审评中心于2019年8月6日发布公告通知:生物学试验报告不强制在具有医疗器械检验资质的检测机构开展;第二类医疗器械注册审批提交的检验报告,不对检验报告中的检验类型进行审查,即不一定要提交注册检验报告,但应提交具有医疗器械检验资质认定和中国计量认证(CMA)且在其承检范围之内按照相关标准进行试验,并开展产品技术要求预评价工作。
卫健委:下月起植入耗材必须记入患者病历!
9月1日起,北京市各级医疗机构将动态监测医用耗材,并且在患者病历中必须记录植介入类医用耗材的相关信息。北京市卫健委此次要求:推行“临床科室不得自行采购”、“耗材用量不得与收入挂钩”、“医用耗材用量实行动态监测”、“植入耗材记入患者病历”等措施,不仅将极大削弱医生出于自身利益而在患者身上过度使用耗材的动力,而且术前和术后的两次“透明化”程序,无疑是要开启院内植介入耗材的最严监管!
《3D打印医疗器械团体标准》(第一册)正式发布
第一批3D打印医疗器械团体标准已于6月28日正式发布,7月20日正式实施,同时第一批团体标准8月10日已正式进入标准贯宣阶段。标准规定了匹配式人工颞下颌关节的产品设计和型式、材料、设计评价、试验方法、质量控制、制造、灭菌、包装、制造商提供的信息的要求,适用于匹配式人工颞下颌关节,该产品适用于口腔颌面外科、耳鼻喉科头颈外科等手术中,对颞下颌关节及相邻骨组织的修复或重建。3D专委会杨静秘书长指出:“3D打印医疗器械团体标准的推广和宣传是非常重要的,不仅有利于推动医工结合,让行业从业人员有“法”可依,做到更好地服务于临床需求;有利于之后的3D打印医疗器械团体标准越来越完善、全面、系统化,更有利于3D打印医疗器械行业未来发展更加的健康化、规范化、有序化。”接下来,3D专委会还将同步开展团体标准的国际推广工作。以下五项团体标准文本及详细信息已在全国团体标准信息平台正式公布:

天津实施医疗器械领域重大科技专项助力新技术推广应用
天津市通过组织实施重大科技专项、重点研发计划等各类科技项目,助力医疗器械新技术的推广和应用,实现部分高端产品的国产化。其中主要包括15个国产医疗器械产品注册证、申请专利47项等重大成果,还包括国家项目8项,中央财政经费支持1.17亿元。近年来,通过专项的支持,天津市共取得了15个国产医疗器械产品注册证、4个欧盟CE注册证书和1个韩国医疗器械产品注册证,申请专利47项,获得发明专利10项,实用新型专利7项,外观设计专利2项,申请软件著作权3项,制订企业标准12项,获得天津市科技进步二等奖1项。2019年,天津市专项重点支持三方面的医疗器械科技研发工作。一是内窥镜手术用有源设备等微创手术器及呼吸机、麻醉机、智能监护仪器等生命支持类医疗器械产品;二是人工心脏、心脏支架、高端骨科植入物、人工晶体等植入介入医疗器械产品;三是新型诊断试剂和配套设备。
康德莱医械获得医疗器械注册证
近日康德莱(603987.SH)公布,公司控股子公司上海康德莱医疗器械股份有限公司(“康德莱医械”)于近日收到国家药品监督管理局颁发的《中华人民共和国医疗器械注册证》,产品名称为一次性使用指引导丝。该产品适用于经皮冠状动脉成形术(PTCA)和经皮血管成形术(PTA)中,引导球囊导管或支架系统送达病变部位。累计已发生研发投入约为人民币220万元。目前国内市场外资品牌的销售占比较高。上述三类医疗器械注册证的取得,是对康德莱医械现有介入类产品线的有效补充,进一步提高康德莱医械核心竞争力,对康德莱医械在介入治疗领域发展和市场拓展具有积极意义。截止目前,该产品尚未在国内进行销售。
河南省药监局通报24家医疗器械生产企业飞行检查情况
2019年8月5日,河南省药品监督管理局发布《关于对河南健威医疗器械有限公司等24家医疗器械生产企业飞行检查情况的通告》。其中,河南健威医疗器械有限公司存在8项问题、新乡市金世康医疗器械有限公司存在9项问题、河南慧超医疗器械有限公司存在3项问题、圣光医用制品股份有限公司存在6项问题、河南德高实业股份有限公司存在7项问题、许昌振德医用敷料有限公司存在5项问题、河南雅康药业有限公司存在6项问题、漯河春晓医疗器械有限公司存在2项问题、河南曙光汇知康生物科技股份有限公司存在1项问题、河南曙光健士医疗器械集团股份有限公司存在2项问题、莲花医疗用品有限公司存在1项问题、南阳市久康医疗器械有限公司存在8项问题、河南汇博医疗股份有限公司存在11项问题、河南省珠峰医疗器械有限公司存在7项问题、固始公元医疗器械有限公司存在6项问题、固始县臻正医疗器械有限公司存在8项问题、固始县康健针灸用品厂存在8项问题、固始县华源针灸针厂存在7项问题,被责令限期整改。
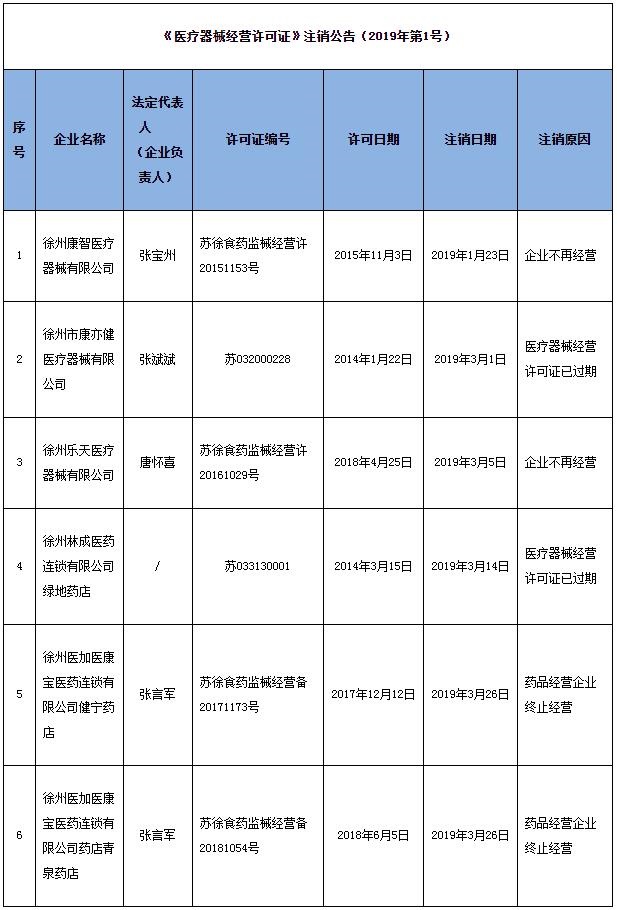
徐州:6家企业《医疗器械经营许可证》注销
徐州市市场监督管理局网站近日发布的《医疗器械经营许可证》注销公告(2019年第1号)显示,6家企业《医疗器械经营许可证》注销:
遭处罚!上海三杏医疗科技涉嫌销售医疗器械给不具资质的经营企业
日,上海市药品监督管理局网站发布沪市监金处字(2019)第282019003061号行政处罚决定书,公布关于上海三杏医疗科技有限公司销售医疗器械给不具有资质的经营企业案的行政处罚决定。该公司分别于2018年1月12日和2018年1月16日从国药集团上海医疗器械有限公司采购了8台血液透析设备,2台血液透析过滤装置,根据《医疗器械经营监督管理办法》第五十四条第三项,处以20000元罚款。
启明医疗率先开启高风险医疗器械冷链配送智慧物流新模式
近期,杭州启明医疗与国药集团在成都签属战略合作协议,提供智慧物联专业的配送方式,开创高风险医疗器械产品冷链配送新模式。根据协议,从8月开始,启明医疗将正式委托国药西南公司负责启明医疗产品在西南的冷链贮运。本次合作是一次高科技医疗器械与规范强大贮运医药网络的强强联合,将大大提高启明医疗介入生物瓣膜产品贮运安全性,提高为医院、患都服务的响应速度。启明医疗与国药集团在全国其它地区的全面冷链贮运合作正在稳步推进中,通过与国药集团的全面合作将在全国率先打造高风险医疗器械冷链配送智慧物流新模式。
应用3D打印手术模型!四川省人民医院机器人微创中心手术成功
四川省人民医院机器人微创中心王东主任,通过四川华曙图灵增材制造技术有限责任公司3D彩色打印技术定制吴女士右肾部的手术模型,协助进行手术分析和规划。四川华曙图灵技术团队利用吴女士CT影像扫描数据将血管、肿瘤等相关组织结构进行多角度、精准三维重建,通过3D打印技术,制备1:1的手术模型。模型采用多彩材质,将肾脏内部及附近的血管、肾盂、肿瘤等不同结构间层次的分界、对应关系通过不同颜色准确清晰标记出来。
受毒蛇启发!超快速无痛贴片注射器已成功出道
最新一期的《Science Translational Medicine》杂志封面,为我们推荐了一项“打破167年针头注射历史”的新型给药研究!科学家们创造出一种液体药物输送贴片,不仅能够让患者承受较少的排斥感和疼痛感,还能够有效快速地将药物输送到皮肤中。来自韩国崇实大学的Bae Won-kyu教授和韩国国立蔚山科学技术研究院(UNIST)的Jung-Hoon Jung教授,模拟毒蛇牙齿,使用半导体工艺制造了一个约1平方厘米的迷你贴片,其中布满100个约两三根头发厚度的微针和多达6条相似的凹槽,通过拇指想皮肤微压,15秒内将液体渗透到体内。
自拍软件有望让血压监测更简单,已登上美国心脏协会期刊
一款基于自拍的软件有望让血压监测更简单。最近,来自加拿大多伦多大学(University of Toronto)和杭州师范大学的研究团队合作,在超过1000名人中验证了这种新技术的准确度,相关结果发表在美国心脏协会(AHA)旗下期刊Circulation: Cardiovascular Imaging。这种新的测量方法通过手机拍摄的视频,利用透皮光学成像技术来监测面部血流变化,在机器学习算法和血压计算模型的基础上最终量出血压。研究人员1,328名加拿大和中国成人中试验了这种“自拍”测血压的新方法。受试人群需要用配有相应软件的iPhone拍摄一段2分钟的视频,并将手机软件测得的收缩压、舒张压、脉压(收缩压和舒张压的差值)数据与传统上臂式血压计的读数进行比对。受试人群中,70%的数据用于训练模型,15%用于测试,其余15%用于验证。

嘉思特3D打印“骨小梁髋关节假体”通过NMPA审批
近日,嘉思特医疗自主研发的“骨小梁髋关节假体”产品(注册证号:国械注准20193130509)获国家药监局(NMPA)批准上市。该产品由由骨小梁臼杯、内衬、内衬加强环、股骨柄体、骨小梁袖套、陶瓷球头组成,嘉思特医疗开发了3种型号的3D打印髋臼杯,均采用电子束熔融3D打印(EBM)制造,“骨小梁髋关节假体”产品成为继北京爱康宜诚医疗之后,又一家获得3D打印髋关节植入物医疗器械注册证的中国骨科医疗器械制造商。
Nexxt Spine金属3D打印“颈椎椎体间融合器”获FDA批准
脊柱植入物及工具生产商Nexxt Spine近日发布消息,SLM金属3D打印的NEXXT MATRIXX 独立颈椎椎体间融合系统已获得美国FDA批准。这种独立的颈椎椎体间融合系统是NEXXT MATRIXX系列的最新产品,目前已经可以向其经销商进行预订。与NEXXT MATRIXX系列的其他产品一样,独立式颈椎系统采用GE Additive的Concept Laser Mlab 3D打印机(基于SLM激光金属3D打印技术)进行制造。据悉,这款设备已经通过了FDA 510(k)许可。独立的颈椎椎体间融合系统设计用于治疗患者的退行性椎间盘疾病,Nexxt Spine正努力准备将该产品推向市场。
FDA批准首款Ⅱ类医疗器械软件!Oleena帮助癌症患者实现自我管理
法国医疗软件开发公司Volunts宣布其数字医疗软件Oleena获FDA批准上市。该数字化工具可帮助癌症患者实现自我管理。Voluntis基于其专有的数字肿瘤治疗平台Teraxium Oncology开发了Oleena,旨在结合患者自我管理和远程医疗监控,为进行放化疗、肿瘤免疫治疗和肿瘤靶向治疗的癌症患者提供服务。Oleena是首款获FDA批准Ⅱ类医疗器械软件(Class II Software-as-a-Medical Device),可用于多种癌症适应症。
Medicrea脊柱内固定系统TULIP GENESIS获FDA批准上市
法国生物技术与医疗器械公司Medicrea International(Medicrea)宣布其脊柱内固定系统TULIP GENESIS获FDA批准上市。Medicrea整合了大量临床和科学数据,将其专有的软件分析工具与大数据、机器学习相结合,主要基于预测医学开发先进技术。该公司在里昂拥有一个超现代化制造工厂,主要利用3D打印技术开发和生产患者特异性钛合金植入物。Medicrea的产品可简化脊柱疾病治疗流程,缩减手术时间并降低手术并发症出现的风险。TULIP GENESIS是一种先进的脊柱内固定系统,主要治疗脊柱畸形等疾病,在市场上具有强大竞争力。
量准公司推出新型蛋白分子互作等离子光学传感芯片设备
近日,量准(上海)实业有限公司(以下简称“量准”)推出一款搭载新型纳米等离子光学传感器(Nanoplasmonic Sensor)芯片的微孔板产品及相应的StarGate SPR100无标记生物分子互作读取设备,实现了表面等离子共振(SPR)设备的突破性进口替代,大幅降低高端药物分子检测设备价格。这款设备由量准独家引进美国最新纳米光学芯片科技知识产权,结合自主研发的传感器设计和纳米制造专利技术,并且从研发伊始就联合国内产、学、研、医行业多家单位共同进行产品使用验证,经过包括协和医院实验室在内的多个科研实验室的独立测试。

英特尔领投!医学影像公司Exo Imaging完成3500万美元B轮融资
8月5日,医学影像公司Exo Imaging宣布完成3500万美元B轮融资,融资资金将用于推动Exo超声波平台发展。本轮融资由Intel Capital(英特尔投资)领投,Applied Ventures、Bold Capital、Creative Ventures、Longevity Vision Fund、Magnetar Capital等十多家投资机构跟投。其中,Intel Capital投资总监Eric King将加入Exo Imaging的董事会。Exo Imaging超声波平台将最先进的纳米材料、传感器技术、先进的信号处理技术与半导体相结合,大大降低了成像成本。
医疗器械研发商“雾联医疗”获数千万人民币A轮融资
8月8日,雾联医疗完成由建银国际领投的数千万人民币A轮融资,点石资本担任本轮融资的财务顾问。此前,该公司曾获深创投、昆山工研院的500万天使轮融资。雾联医疗是一家成立于呼吸系统医疗保健器械研发商,利用纳米级雾化微孔技术,确保药物和颗粒动力效率平稳,为用户提供雾化治疗服务。产品包含雾化器系列、储雾罐系列、体温量测系列、智能呼吸训练器等,同时提供OEM及ODM服务,产品获得CE、Reach、RoHS、Imetro等多项国际认证。不仅如此,雾联医疗还拥有覆盖雾化吸入给药的核心技术的60多项发明专利。
百康芯完成国药资本领投近七千万元B轮融资
8月9日,北京百康芯生物科技有限公司(“百康芯”)宣布完成近七千万元人民币B轮融资,本轮融资由国药资本领投,公司现有股东亦参与跟投。至此,百康芯已累计获得知名医疗基金注资逾亿元。强云资本再次担任百康芯本轮融资独家财务顾问。百康芯成立于2013年,致力于自动化核酸检测系统的研发、生产和销售,公司总部位于北京昌平,生产子公司位于天津武清。公司依托微流控芯片平台技术,致力于开发急重症呼吸道、消化道、血液、泌尿等疾病领域的致病微生物快速核酸检测产品,现已开发出多个产品平台。
GNA Biosolutions完成1350万美元C轮融资,新开发分子诊断平台
德国分子诊断公司GNA Biosolutions宣布完成1350万美元C轮融资。本轮融资所得将用于推进 GNA Biosolutions的第一个护理分子诊断平台的开发和体外诊断设备(IVD)CE认证。本轮投资机构包括原股东SHS Gesellschaft für Beteiligungsmanagement、Robert Bosch Venture Capital、UVC Partners、Mey Capital Matrix、KfW和Btov Partners,以及新股东GreyBird Ventures、Occident Group和Wachtumsfonds Bayern。GreyBird Ventures合伙人Tom Miller先生将会在本轮融资结束后出任GNA Biosolutions董事会主席。据悉,GNA Biosolutions曾于2011年3月完成A轮融资,融资金额及投资方未披露。2015年6月完成600万美元B轮融资。该公司基于其下一代核酸扩增技术——脉冲控制扩增技术(Pulse Controlled Amplification–PCA),开发了一种新颖、高效且经济的分子诊断平台。GNA Biosolutions的PCA平台能够直接从复杂样本,如全血、唾液以及鼻腔拭子中捕获核酸并进行扩增,并且不需要额外的样本制备步骤。整个过程仅需数分钟完成,大大减少了手动操作的时间。
传染病诊断产品研发公司Lucira Health完成1500万美元B轮融资
Lucira Health,一家无仪器、分子传染病检测产品开发商,B轮融资1500万美元收盘。该轮融资由瑟拉夫集团领投,Eclipse Ventures、DCVC(Data Collective)、Y Combinator和Sunstone Management跟投。此外,ShangBay Capita对该公司进行了首次投资。该资金将用于监管审批和早期商业化。Lucira Health成立于2013年,目前正在开发基于DNA和RNA的传染病诊断工具,如呼吸系统疾病,性传播感染的疾病等。
Babylon Health完成5.5亿美元C轮融资,开发慢性病AI诊断平台
Babylon Health完成5.5亿美元C轮融资,本轮融资由Saudi Arabia's Public Investment Fund领投,Kinnevik AB、Vostok New Venture和Munich Re Ventures跟投。本轮融资后,Babylon Health将把业务范围扩大至美国和亚洲,并进一步研发针对严重慢性病的AI诊断平台。据悉,Babylon Health分别于2016年和2017年完成了A轮和B轮融资,融资金额分别为250万美元和470万美元。Babylon Health与腾讯、TELUS和三星有合作关系,在英国、卢旺达和加拿大提供临床服务。Babylon人工智能医生是Babylon Health最近推出的一款远程诊疗App,能够为用户提供全天候医疗咨询服务。
医疗设备公司Vapotherm拟募资5740万美元,开发Hi-VNI无创通气技术
生物技术与医疗设备公司Vapotherm宣布发行260万股股票,计划募集资金5740万美元。Vapotherm将利用此次募集资金扩大公司规模,开发Hi-VNI无创通气技术及其他呼吸治疗设备。据悉,此前Vapotherm曾完成11次融资。其中该公司于2017年5月完成4500万D轮融资,于2015年7月完成2000万C轮融资。Vapotherm专注开发先进呼吸治疗设备,以改善患者治疗效果。Vapotherm于2018年在纽约证券交易所上市,股票代码为VAPO。
新华医疗拟收购淄博弘新,实现骨科和血液透析协同规模效应
近日,山东新华医疗器械股份有限公司发布公告称,公司拟斥资2.65亿元收购国际信托所持的淄博弘新76.12%股权。收购完成后,新华医疗将持有淄博弘新100%的股权。受此消息影响,截至今日收盘,新华医疗股价收于15.94元/股,涨幅1.85%。对于此次收购目的,公告归纳为,“公司此次收购淄博弘新股权有利于扩展公司医疗服务板块,有利于公司实现骨科和血液透析产业链的协同和规模效应。”但是,淄博弘新近年的盈利情况并不佳,收购原本存在风险。从数据看,靠“卖卖卖”和政府补助扭亏似乎已经成了新华医疗近年来的常态,导致其商誉风险加大。
11亿美元!西门子医疗收购Corindus Vascular Robotics
8月8日,医疗机器人开发公司Corindus Vascular Robotics宣布,已与西门子医疗保健公司(Siemens Healthineers AG)达成最终的并购协议。根据合并协议的条款,西门子医疗保健公司的全资子公司——西门子医疗,将以每股4.28美元的现金收购Corindus所有已发行的普通股,合计购买价约11亿美元。该交易已获得Corindus董事会的批准,预计将于2019年第四季度完成。花旗环球市场有限公司(Citigroup Global Markets)将担任Corindus的独家财务顾问,凯威莱德律师事务所(Cadwalader, Wickersham & Taft LLP)将担任其法律顾问。该公司公司致力于设计、制造和商业化用于介入治疗的远程精密机器人辅助系统(简称“CorPath®系统”)。
DW Healthcare Partners收购医疗设备公司CEFALY Technology SPRL
8月7日,DW Healthcare Partners收购医疗设备公司CEFALY Technology SPRL,具体交易细节尚未披露。本次收购后,CEFALY Technology将进一步开发和销售旗下偏头痛治疗设备。此外,Jen Trainor将成为CEFALY Technology的首席执行官,他在销售、运营和多渠道产品分销方面拥有丰富的国际经验。据悉,2019年7月23日,DW Healthcare Partners的第五只基金筹集了6.1亿美元资金,CEFALY Technology是DW Healthcare Partners的第一个合作公司。
Cardiovascular Systems收购Gardia Medical旗下栓塞保护系统
Cardiovascular Systems收购Allia Medical Solutions旗下医疗设备公司Gardia Medical的栓塞保护系统WIRION Embolic Protection System以及相关资产。此次收购后,Cardiovascular Systems将把WIRION栓塞保护系统转移到美国进行商业化生产,整个交接过程将在12至15个月后完成。Gardia将保留在颈动脉成形术和支架置入术过程中使用WIRION系统的权利。Gardia Medical成立于2009年,总部位于以色列,致力于开发和商业化适用于心血管介入治疗程序的导管输送系统。此外,Gardia也生产栓塞保护装置,该公司生产的WIRION于2015年6月获得CE认证,2018年3月获得FDA批准。
Progentec Diagnostics与Karate Health合并,开发自身免疫性疾病诊疗平台
医疗技术公司Progentec Diagnostics(Progentec)与Karate Health宣布合并,以共同打造自身免疫性疾病诊疗平台,为系统性红斑狼疮(SLE)和多发性硬化症(MS)患者开发创新治疗技术。本次交易未披露任何财务条款。Progentec专注开发先进的疾病诊断干预措施,以满足患者医疗需求。此外,Progentec还将这类诊断干预措施与数字技术结合,改善患者治疗效果。Karate Health主要开发医疗应用软件,为SLE、MS、类风湿性关节炎(RA)、克罗恩病、1型糖尿病和其他复杂疾病患者提供医疗服务。

赛诺医疗过会科创板,专利授权存风险,上市陷中止
专注于高端介入医疗器械研发、生产、销售的赛诺医疗,于7月31日科创板的发审会上获得通过。值得关注的是,公司虽然过会,但依然有不少令人担忧的地方,其中包括公司独占许可专利授权的风险,以及公司因连续三年被飞检通报限期整改而列入失信核查名单,目前失信核查结果还未公布。目前,赛诺医疗上市进程处于“中止”状态。

技术角度看医疗器械市场:新技术、新工艺、新材料突破不断
从技术角度来看,新技术、新工艺、新材料等方面的快速发展大大促进国内高端植入性医疗器械不断突破技术瓶颈。新材料技术作为当前世界新技术革命的三大支柱之一日益繁荣,尤其是高分子材料、复合材料发展迅速,在生物医用材料、骨科固定等方面不断拓展。从2009-2018年我国新材料行业相关专利申请数量来看,我国新材料行业产品更新技术速度发展快速。
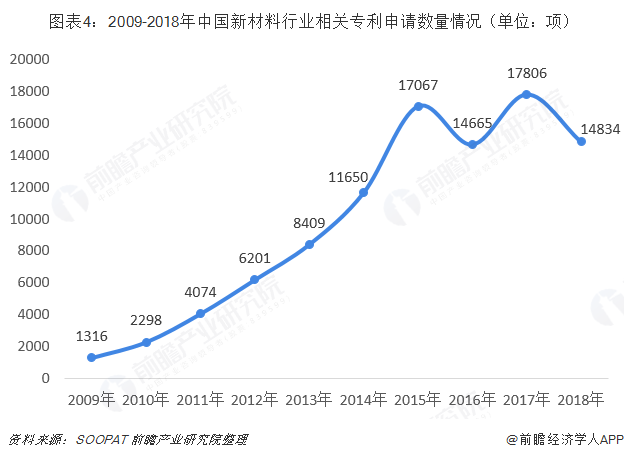
3D打印技术迅猛发展,并已经开始应用于临床医疗,实现各类植入性医疗器械的精准复制;PLA全降解技术、纳米工艺处理技术、可降解药物涂层、新洗脱药物开发等技术研发成果显著。同时,植入性医疗器械行业龙头企业营业收入不断增长,对于研发的投入比例不断扩大,冠昊生物、乐普医疗、和佳股份等龙头企业研发投入均保持营业收入的4%以上,这将进一步促进企业开展新品研发、提高产品质量、占领高端市场。


2018年中国骨科植入销售262亿元,未来国产替代空间巨大
得益于我国庞大的人口基数、社会老龄化进程加速和医疗需求不断上涨,我国骨科植入类市场销售规模由2014年的139亿元增长至2017年的225亿元,但受集中采购、国产“进口替代”等因素影响,近几年骨科植入市场规模增长逐渐放缓,据医械研究院测算,2018年骨科植入物市场销售规模约为262亿元,比2017年的225亿元增长了37亿元,增长率为16.4%。

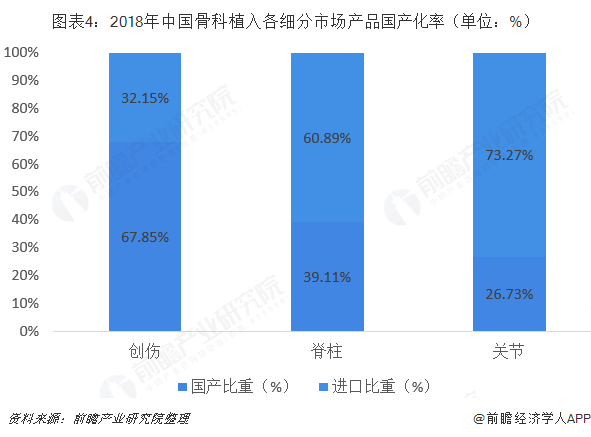
我国骨科植入类医用耗材市场分为四大类,除运动医学类产品以外,创伤类、脊柱类和关节类是最主要的骨科植入类耗材,三大市场占据市场85.50%的份额。脊柱超越创伤成为最大的细分市场,占29.01%;创伤排名第二,占28.63%;关节排名第三,占27.86%。随着我国居民消费能力的提高、国内医疗保险制度的完善、临床医生治疗水平的整体提升,我国脊柱类和关节类耗材产品的市场份额将进一步提高。

目前我国骨科植入市场依旧是进口企业占据多数份额,但随着进口替代的逐步推进,国产企业的市场份额将会不断提升,据医械研究院数据显示,2018年,中国骨科植入市场排名前二十的生产企业共占据57.34%的市场份额,其中6家进口企业共占据38.84%的市场份额,14家国产企业共占据18.50%的市场份额。

盘点2018年全球10大骨科医疗器械公司
医疗器械行业网站Medical Design & Outsourcing近日发布了《2018年全球10大骨科医疗器械公司》榜单,并列举了相关公司的近期进展。以下是具体详情:


什么是CFDA?
实际上CFDA是国家食品药品监督管理总局的简称,如果一家公司想在中国境内销售、使用的医疗器械产品均应按照规定向CFDA进行申报注册,未经核准注册的医疗器械,不得销售使用。认证还分为境内医疗器械注册和境外医疗器械注册,境外医疗器械不管是一类、二类、三类都要到北京国家食品药品监督局办理;境内的一、二类医疗器械在当地的省或市食品药品监督局办理,三类的到国家食品药品监督局办理。医疗器械注册证说白了就是医疗器械产品的合法身份证。
CFDA申请注册审核严格、周期长、收费高。以国产第三类医疗器械为例,申请人按照首次注册审批服务指南的要求,向国家食品药品监督管理总局行政受理服务大厅提出申请,受理人员根据申报事项按照《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》(2014年第43号)、《关于印发境内第三类和进口医疗器械注册审批操作规范》、《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(2014年第44号)的要求对申报资料进行形式审查。

2019未来医疗100强大会
时间:2019年12月20-22日(周五、周六、周天)
地点:北京
推荐票种:超级盲选票
您的信任将获得如下权益:1、3天论坛+展会通票;2、2份报告(电子版);3、现场资源对接群;4、3天参会午餐券;5、嘉宾授权PPT等资料。
2019未来医疗100强大会,将以未来医疗100强榜单、未来医疗100强系列奖项的发布为契机,面向20余个热点领域,聚集国内外最为活跃的医疗健康创新企业、上市公司、金融机构、医疗机构等。这将是一场以“论坛+展览+榜单+报告+私密酒会”为抓手,连接10000人、1000家创新企业参与的医健产业与资本融合的盛会。
2019中国医疗器械创新创业大赛复赛将在北京举办
8月16-18日,大赛将于北京举办材料与配件技术(16日)、光机电(17日)、体外诊断(18日)三个方向的复赛。届时三个方向各20个总计60个优秀创新创业项目进行现场路演,现场每个项目展示环节20分钟,其中项目演讲时限15分钟,专家评委问答及打分5分钟。最后按照按评分高低,每个方向现场评选出一等奖2个,二等奖3个,三等奖5个,优秀奖10个。最终材料与配件技术、光机电、体外诊断三个方向项目按复赛评分结果将公示,并进行全国排名,前15名晋级9月5日在苏州和昆山举办的全国总决赛。

品牌、内容合作请点这里:寻求合作 ››


 让您成为更懂趋势的人
让您成为更懂趋势的人
想看更多前瞻的文章?扫描右侧二维码,还可以获得以下福利:

下载APP

关注微信号


扫一扫下载APP
与资深行业研究员/经济学家互动交流让您成为更懂趋势的人
违法和不良信息举报电话:400-068-7188 举报邮箱:service@qianzhan.com 在线反馈/投诉 中国互联网联合辟谣平台
Copyright © 1998-2025 深圳前瞻资讯股份有限公司 All rights reserved. 粤ICP备11021828号-2 增值电信业务经营许可证:粤B2-20130734