


国家卫健委称奥密克戎疫苗进入临床阶段
5月27日,中国疾控中心免疫规划首席专家王华庆介绍,新冠病毒奥密克戎变异株使得新冠病毒传染性强、传播速度更快、传播过程隐匿,感染风险在加大。目前新冠病毒疫苗对重症死亡的预防效果依然明确且显著,而且完成现有疫苗全程接种和加强针接种效果更好。开展奥密克戎株疫苗的研究是在未来期望增加应对新冠病毒的手段。奥密克戎变异株的疫苗虽然进入临床试验,确定其研究结果还需要时间,病毒的进化还有一些不确定性。
《2022年医药研发趋势年度分析》白皮书发布
2022年5月,全球医药智库信息平台InformaPharmaIntelligence线上发布的《2022年医药研发趋势年度分析》白皮书提出:2021年间,Pharmaprojects数据库增加了6343种新研发候选药物。新增药物中,超过38.8%的药物为抗癌药,神经药物占比14.7%排列第二,而以新冠相关药物为主的抗感染类药物仅以12.0%的占比位居第三,远低于用于一种或多种罕见病新药的占比(17.5%)。

国务院办公厅印发深化医药卫生体制改革2022年重点工作任务
5月25日,国务院办公厅印发深化医药卫生体制改革2022年重点工作任务,提出2022年力争每个省份国家和地方采购药品通用名数合计超过350个、开展医疗、医保、医药联动促进中医药传承创新发展试点、推行以按病种付费为主的多元复合式医保支付方式、提高重大疫情监测预警、流调溯源和应急处置能力、推进医疗服务价格改革年底前将医疗服务价格调出成本监审和价格听证目录等。
《特异性人免疫球蛋白药学研究与评价技术指导原则》发布
近日,为规范和指导特异性人免疫球蛋白的研发、生产和注册,进一步明确技术评价标准,在国家药品监督管理局的部署下,药审中心组织制定了《特异性人免疫球蛋白药学研究与评价技术指导原则》。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。

康希诺生物发布新冠吸入式疫苗预防新冠效果积极
5月24日,康希诺官方微信号“康希诺生物CanSinoBIO”发布消息称,其新冠吸入式疫苗预防新冠效果积极,相关成果发布在《柳叶刀-呼吸病学》医学期刊上。康希诺的这次临床试验针对的是加强针,参与临床420名接种受试者都是接种过2剂灭活疫苗的,分为三组,其中两组分别使用0.1ml和0.2ml的吸入用新冠疫苗,第三组使用肌肉注射灭活疫苗。结果显示,使用康希诺吸入疫苗28天后,针对原始毒株的中和抗体水平,两组分别是灭活组的18.4倍和26.4倍;针对Delta变异毒株的中和抗体水平是灭活组的18.1倍和24倍。同时,不良反应低于灭活组。值得注意的是,该试验并未包括传播力更强的奥密克戎变异毒株。
EMA批准阿斯利康新冠疫苗Vaxzevria用作成人加强针
5月23日,阿斯利康表示,其新冠疫苗Vaxzevria已被欧洲药品管理局(EMA)批准,作为用于成人的加强针疫苗。上周四,阿斯利康的新冠疫苗加强针(临床试验数据)便获得了CHMP(欧洲人用医药产品委员会)的积极评估。

企业布局
诺华创新药中国管理团队人员架构调整
近日,诺华中国也开始了新的架构调整,对于诺华创新药中国管理团队人员架构公布,下月初,即6月1日正式执行。其中,创新药物中国总裁兼董事总经理 张颖, 将担任创新药物中国心血管治疗领域临时负责人现任心血管、肾科和代谢事业部负责人Johan Kahistroem将在公司内转;严琼被任命为创新药物中国免疫治疗领域负责人。县域团队将继续向严琼汇报。
拜耳架构大调整:合并心血管和糖尿病,成立肿瘤事业部
5月27日,拜耳宣布了新的架构调整,一是成立肿瘤事业部,二是合并了心血管和糖尿病,更名为代谢治疗领域,生效时间为2022年6月1日。新成立的肿瘤事业部将由韩爽领导。她将成为中国处方药管理团队的一员,base北京,并向拜耳处方药事业部执行副总裁兼中国区总裁周晓兰进行汇报。新的CVRM团队将聚焦于确保Kerendia、Dorzagliatin和连续血糖监测系统(CGM)在中国的成功上市,并积极应对即将到来的Adalat的带量采购。
企业合作
盐野义逾4.8亿美元助力开发新型抗真菌药物
近日,盐野义和F2G公司宣布达成战略合作,在欧洲和亚洲开发和商业化用于治疗侵袭性真菌感染的新型抗真菌药物olorofim。根据协议条款,盐野义将在欧洲和亚洲对olorofim进行治疗IA的临床试验以及随后的注册和商业化。盐野义将向F2G支付1亿美元的预付款,并在全球研究中分担开发成本。F2G还将有资格获得最高达3.8亿美元的额外监管和商业里程碑。
辉瑞与数字治疗合作伙伴合作推出针对特异性皮炎产品
数字治疗公司 Sidekick Health 与制药巨头辉瑞公司联手推出针对特应性皮炎(AD)的集成数字治疗解决方案。该解决方案将首先在英国推出,今年晚些时候将在比利时、挪威、荷兰、瑞典、法国、爱尔兰和日本推出。标志着Sidekick和辉瑞之间不断加强合作的下一阶段,以在全球范围内开发数字患者支持计划,包括到2024年扩展到24个市场。
人事变动
润佳医药任命叶祥胜博士为首席科学官
近日,润佳医药宣布,正式任命叶祥胜博士为公司首席科学官,全面负责公司科研管理,包括创新药研发的管理和推动及新管线的扩展,并联合君实生物建立转化医学研究中心。
诺华全球药品开发(中国)负责人王兴利离职
5月24日,业内人士透露,诺华全球药品开发(中国)负责人已离开诺华,新去向暂未公布。据了解,王兴利目前已加入诺华已经11年,主要带领诺华临床开发团队。
阿斯利康中国原消化与呼吸雾化事业部总经理陈鹏亘离职
5月27日,原阿斯利康中国消化与呼吸雾化事业部总经理陈鹏亘先生离开阿斯利康中国,寻求外部发展机会,最后工作日位2022年5月31日。新事业部将由现任阿斯利康中国副总裁、呼吸及自体免疫事业部负责人林骁带领。原先消化与呼吸雾化事业部负责人陈鹏亘去向将后续通知。现任阿斯利康中国助理副总裁杨在峰将继续领导消化及呼吸雾化业务部呼吸雾化产品、消化针剂产品、消化口服产品的销售团队,直接向中国副总裁,呼吸、消化及自体免疫事业部负责人林骁汇报。

之江生物猴痘病毒核酸测定试剂盒获欧盟CE认证
5月23日,之江生物发布公告称,公司自主研发生产的猴痘病毒核酸测定试剂盒(荧光PCR法)已经欧盟CE认证,可助力相关疫病的诊断与防控。
诺华Cosentyx(司库奇尤单抗)获欧盟CHMP推荐批准
5月23日,诺华(Novartis)近日宣布,欧洲药品管理局(EMA)人用医药产品委员会(CHMP)已发布一份积极审查意见,推荐批准抗炎药Cosentyx(中文商品名:可善挺,通用名:secukinumab,司库奇尤单抗,俗称“苏金单抗”),作为一种单药疗法或联合甲氨蝶呤,用于年龄在6岁及以上、对常规治疗应答不足或不耐受的儿科患者,治疗2种类型的幼年特发性关节炎(JIA)——附着点炎相关关节炎(ERA)和幼年银屑病关节炎(JPsA)。
美国FDA批准Dupixent(达必妥):显著改善吞咽困难和食道炎症
5月23日,赛诺菲(Sanofi)与合作伙伴再生元(Regeneron)近日联合宣布,美国食品和药物管理局(FDA)已批准抗炎药Dupixent(中文商品名:达必妥,通用名:度普利尤单抗,dupilumab),用于治疗嗜酸性食管炎(EoE)成人患者和儿童患者(≥12岁,体重≥40公斤)。此次批准代表了Dupixent在胃肠道疾病中的第一个适应症,同时也代表着该药获批的第4个适应症。
沃森生物:双价HPV疫苗首批产品获得批签发证明
5月24日,沃森生物发布公告称,控股子公司上海泽润生物的全资子公司玉溪泽润生物生产的双价人乳头瘤病毒疫苗(毕赤酵母)首批产品已获得国家药监局签发的《生物制品批签发证明》。该产品主要用于预防女性因高危型HPV16、18型所致的宫颈癌等疾病。获得首批批签发证明,标志着该产品正式投放市场。
欧盟CHMP推荐批准Olumiant(巴瑞替尼)
5月25日,欧洲药品管理局(EMA)人用医药产品委员会(CHMP)已发布一份积极审查意见,推荐批准口服JAK抑制剂Olumiant(中文商品名:艾乐明,通用名:baricitinib,巴瑞替尼),用于治疗成人重度斑秃(alopecia areata,AA)。
迈威生物阿达木单抗君迈康®全国首张处方落地
5月25日,迈威生物的阿达木单抗君迈康®的全国首张处方落地。哈尔滨医科大学附属第一医院风湿免疫科张志毅教授为一位强直性脊柱炎患者处方了君迈康®。这标志着君迈康®正式实现商业化。君迈康®是由迈威生物和君实生物共同开发的阿达木单抗注射液,今年一季度正式获得国家药品监督管理局(NMPA)上市许可批准,用于类风湿关节炎、强直性脊柱炎、银屑病的治疗,曾获得“十二五"国家”重大新药创制"科技重大专项支持。
双鹭药业:获得伏立康唑片药品注册证书
5月26日,双鹭药业公告,获得伏立康唑片药品注册证书。伏立康唑属于第二代三唑类的抗真菌感染的药物,分子结构简单,抗菌谱较广,尤其对曲霉菌具有较高的抗菌作用,不良反应少,临床患者耐受性好。伏立康唑主要有口服和注射两种剂型,均有良好的抗真菌活性,口服给药能在2小时内迅速吸收且生物利用度高达96%。在有临床指征时口服制剂和静脉滴注两种给药方式可以互换。
阿斯利康Selumetinib胶囊获CDE优先审评
5月26日,CDE官网公示,阿斯利康Selumetinib胶囊拟纳入优先审评。Selumetinib是世界上第一个被批准用于治疗儿科实践中1型神经纤维瘤病丛状神经纤维瘤(PN)的药物。
IDH1抑制剂组合疗法治疗急性髓系白血病获FDA批准
5月26日,施维雅宣布,美国FDA已批准IDH1抑制剂Tibsovo(ivosidenib)与阿扎胞苷联用,一线治疗携带IDH1突变的急性髓系白血病患者。这些患者年龄超过75岁,或者由于合并症无法接受强力诱导化疗。
正大天晴/首药控股新一代ALK抑制剂递交上市申请
CDE官网公示,正大天晴南京顺欣制药已经递交了TQ-B3139胶囊的上市申请,并获得受理。公开资料显示,TQ-B3139为新一代ALK抑制剂,由正大天晴与首药控股合作研发。该药已经于2019年开展3期临床,评价其对初治ALK阳性晚期非小细胞肺癌患者的安全性和有效性。

单抗/双抗
圣森生物PD-1单抗MW11注射液获批临床
5月23日,国家药审中心信息显示,圣森生物PD-1单抗MW11注射液获批临床,与溶瘤病毒候选药物BS001(OH2)注射液联用,拟定适应症为晚期不可手术切除、标准治疗失败的实体瘤。据悉,MW11是迈威生物自主研发的创新重组人源化抗PD-1单克隆抗体,9MW1111通过与T细胞表面的PD-1结合,阻断PD-1与配体PD-L1和PD-L2的结合,从而消除PD-1信号传导通路的免疫抑制,恢复T细胞攻击肿瘤细胞的免疫功能
齐鲁制药1类新药QL1706注射液获得临床试验默示许可
5月23日,CDE官网显示,齐鲁制药的1类新药QLH11906片、QL1706注射液获得临床试验默示许可,拟用于晚期实体瘤、小细胞肺癌。大分子生物药QL1706注射液(PD-1/CTLA-4双抗)新增适应症获批临床,用于治疗广泛期小细胞肺癌。
嘉和生物CD20/CD3双特异性抗体GB261获批开展1/2期临床
5月24日,嘉和生物宣布,其CD20/CD3双特异性抗体GB261获得中国国家药品监督管理局(NMPA)1/2期临床试验默示许可,拟用于复发或难治性B细胞非霍奇金淋巴瘤(B-NHL)和慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)患者的治疗。在海外,GB261已经在澳大利亚达成首次人体临床试验(FIH)的首位患者给药。公开资料显示,GB261由AB Studio公司高低双抗平台设计并由嘉和生物进一步开发,是一个与CD3低亲和力结合并保持Fc功能(ADCC和CDC)的T细胞接合器(T Cell Engager)。
百奥赛图/祐和医药将公布CD40单抗最新临床研究数据
5月24日,百奥赛图(北京)医药科技股份有限公司全资子公司祐和医药宣布,将在2022年美国临床肿瘤学会(ASCO)年会上分别以壁报的形式公布其自主研发的YH003(CD40单抗,摘要编号2603)及YH001(CTLA-4单抗,摘要编号2602)的最新澳洲I期临床研究数据。研究显示,在与PD-1单抗联用的情况下,YH003和YH001均显示出较高的耐受剂量和初步的抗肿瘤活性。
强生公布Tremfya(古塞库单抗)和Stelara(乌司奴单抗)新数据
5月26日,强生(JNJ)近日在2022年美国消化疾病周(DDW)会议上公布了新型抗炎药IL-23抑制剂Tremfya(中文商品名:特诺雅,通用名:guselkumab,古塞库单抗)治疗中度至重度活动性克罗恩病(CD)成人患者2期GALAXI 1临床试验(NCT03466411)的新数据,以及评估抗炎药Stelara(中文商品名:喜达诺,通用名:ustekinumab,乌司奴单抗)治疗溃疡性结肠炎(UC)和CD成人患者3项单独的长期汇总分析。
天境生物公布差异化CD73抗体尤莱利单抗2期临床研究最新数据
5月27日,在2022年美国临床肿瘤学会(ASCO)年会上,天境生物公布了正在中国进行的尤莱利单抗联合特瑞普利单抗(拓益 )治疗非小细胞肺癌(NSCLC)2期临床试验的初步研究数据(截至2021年12月)。数据显示,尤莱利单抗具有优异的安全性和药代动力学/药效动力学(PK/PD)特征,与1期临床研究结果基本一致。在达到预设的最高剂量时(30mg/kg每三周给药),尤莱利单抗无论是单药治疗还是联合特瑞普利单抗治疗均展现出良好的安全性和耐受性,未观察到剂量限制性毒性(DLT)事件。
Seagen公司:HER2口服抑制剂组合疗法关键性2期临床结果积极
Seagen公司宣布,其口服HER2抑制剂Tukysa(tucatinib),与抗HER2单克隆抗体trastuzumab联用,在治疗HER2阳性转移性经治结直肠癌(mCRC)患者的关键性2期临床试验中获得积极顶线结果。Tukysa是一款口服HER2酪氨酸激酶抑制剂,与曲妥珠单抗和卡培他滨联用,用于治疗手术无法切除或转移性经治晚期HER2阳性乳腺癌成人患者。
先进疗法
恒瑞医药1类新药SHR3680 III期研究达到主要终点
5月24日,恒瑞宣布,其创新药SHR3680片治疗高瘤负荷的转移性激素敏感性前列腺癌的III期临床达到主要研究终点。结果表明,SHR3680片可显著延长高瘤负荷的mHSPC患者的总生存期。
创新抗癌疗法nirogacestat达到3期临床终点
5月25日,SpringWorks Therapeutics公司宣布,其口服特异性γ-分泌酶小分子抑制剂nirogacestat,在治疗疾病进展的硬纤维瘤(desmoid tumors)患者的3期临床试验中达到主要终点,将患者疾病进展风险降低71%。基于这一积极结果,该公司计划在今年下半年向美国FDA递交新药申请。
辉瑞宣布NASH治疗方法获得FDA快速通道指定
5月26日,辉瑞公司宣布美国食品药品监督管理局(FDA)授予组合治疗药物ervogastat/clesacostat快速通道指定。该疗法旨在治疗伴有肝纤维化的非酒精性脂肪性肝炎(NASH)患者。在非临床研究和组合疗法的IIa期临床研究中,该疗法能有效减少肝脏脂肪,同时显示出良好的安全性和耐受性。目前,该疗法正在进行的II期临床试验中进行研究,评估该疗法对解决NASH或改善肝脏纤维化的影响。该研究预计将于2024年完成,并将为未来的III期临床试验提供信息。
Sovateltide治疗急性中风3期临床结果积极
5月26日,Pharmazz宣布,在研疗法sovateltide在治疗急性缺血性卒中的3期临床试验中获得积极结果。试验结果显示,接受治疗90天后,sovateltide为患者的神经学结局提供统计显著并具有临床意义的改善。根据评估中风症状的改良兰金量表的评估,更多接受sovateltide治疗的患者达到mRS评分改善超过2分的标准(p=0.0045)。Sovateltide组患者mRS评分改善幅度的中位值,以及NIHSS评分改善超过6分的患者比例也显著超过对照组。
杨森公布guselkumab治疗克罗恩病积极3期临床结果
强生旗下杨森制药公司公布了TREMFYA ® (guselkumab)用于中度至重度活动性克罗恩病成人患者的GALAXI 1期临床试验的新数据。GALAXI 1数据显示,对常规疗法和/或用TREMFYA治疗的生物制剂反应不足或不耐受的研究参与者实现了高水平的临床生物标志物反应a(47.5-66.7%)、内窥镜反应b(44.3-46%)和跨剂量组在48周时C反应蛋白(CRP)≤3 mg/L或粪便钙卫蛋白 ≤250μg/g (39.3-66.7%)的临床缓解。
礼来IL-23p19抑制剂mirikizumab维持治疗溃疡性结肠炎(UC)
礼来(Eli Lilly)近日在2022年美国消化疾病周(DDW)会议上公布了新型抗炎药mirikizumab治疗中重度活动性溃疡性结肠炎(UC)关键3期LUCENT-2研究(NCT03524092)的详细结果。数据显示,接受mirikizumab维持治疗的患者中,有一半在一年后达到临床缓解(49.9%;n=182/365);而在接受mirikizumab治疗实现临床缓解的患者中,几乎全部在一年后没有服用皮质类固醇,即实现无皮质类固醇临床缓解(97.8%,n=178/182)。

阿里健康2022财年经调整净亏3.94亿元
5月25日,阿里健康发布2022财年年报。报告显示,2021年4月1日-2022年3月31日:公司营收为205.78亿元,同比增长32.6%;毛利41.08亿元,毛利率为20.0%,同比下降3.3个百分点。归属母公司净亏损2.66亿元,同比止盈转亏,去年同期净利3.43亿元。经调整后亏损净额约为3.94亿元,去年同期约为6.31亿元,利润减少超10亿元。
星昊医药2022年一季度净利1420.81万元
5月25日,星昊医药(代码:430017.NQ)发布2022年一季报业绩报告。2022年1月1日-2022年3月31日,公司实现营业收入1.07亿元,同比下降17.67%,净利润1420.81万元,同比增长2.47%。公司所属行业为医疗服务。公司报告期内,期末资产总计为13.32亿元,营业利润为1488.40万元,应收账款为7484.91万元,经营活动产生的现金流量净额为603.72万元,销售商品、提供劳务收到的现金为1.07亿元。
“免疫之王”艾伯维一季度财报亮眼
全球“免疫之王”艾伯维在2022年第一季度强势开局,奏响春天冲刺的“交响曲”。第一季度,艾伯维全球营收135亿美元;净利润44.9亿美元,同比增长26%。两颗免疫“超新星”担纲增长“新引擎”,合并在一季度将超过14亿美元纳入囊中,并在全球及中国市场频频获批新适应症,一路领跑。

数字疗法公司Feel Therapeutics宣布获得SeedtoB Capital投资
5月23日,开发生物标志物和数字疗法的公司Feel Therapeutics已获得SeedtoB Capital投资。该公司致力于改变诊断、管理和护理心理健康的方式。其心理健康解决方案包括:Feel Relief,每月一次的数字订阅,以减少压力、促进睡眠和改善情绪健康;Feel Program,一个与远程健康监测相结合的心理健康患者支持计划;以及Feel DTx,世界上首个数据驱动的数字疗法,通过数字认知行为疗法(CBT)、健康教练和及时干预,向有需要的人提供支持,治疗重度抑郁症和焦虑症患者。
载裕生物获天使轮投资,由沐盟集团领投
5月23日,杭州载裕生物技术有限公司获沐盟集团天使轮融资。本轮融资由沐盟集团领投,沐盟集团作为一家专业的产业金融服务集团,多年以来持续关注大健康领域,不断布局在生物医药方向的投资,先后投资华诺泰、华氏医药、江夏血液等明星企业,本轮作为领投方,也表示出沐盟集团要继续深耕生物医药产业的信心。载裕生物组建于
华津医药完成数千万美元融资
5月24日,华津医药宣布完成数千万美元级别pre-B轮融资,本轮融资由稳正资产领投,跟投方为同学村创投、谢诺投资、华睿基金。本轮融资款将主要用于原创性first-in-class溶瘤细菌产品的研发,推进全球首个肿瘤靶向氨基酸代谢通路调控溶瘤细菌生物制品SGN1的开发,加速其在全球范围临床管线进程。
晟迪生物医药完成数千万元天使轮融资
近日,晟迪生物医药(苏州)有限公司(Scindy Pharmaceutical (SuZhou))宣布完成数千万元天使轮融资。本轮融资由薄荷天使基金、Center Biotherapeutics共同领投、十棱基金跟投。此次募集资金将用于自主知识产权脂质纳米递送(Lipid Nanoparticle,LNP)平台建设,推进纳米递送系统在疫苗、蛋白替代、基因编辑等领域的应用,开发具有显著临床价值的创新药物。

星昊医药完成北交所上市辅导验收
5月26日,新三板企业星昊医药(430017.NQ)于近日发布了申请公开发行股票并在北京证券交易所上市辅导验收完成的提示性公告。公告显示,北京星昊医药股份有限公司(以下简称“公司”)于2021年7月13日与申万宏源证券承销保荐有限责任公司(以下简称“申万宏源承销保荐”)签署《公开发行股票并进入精选层辅导协议》。公司于2021年7月20日向中国证券监督管理委员会北京监管局报送了辅导备案申请材料,辅导机构为申万宏源承销保荐。

全球生物医药行业专利技术周期:处于成长期
2010-2020年,全球生物医药行业专利申请人数量及专利申请量均呈现增长态势。2020年全球生物医药行业专利申请量及专利申请人数量分别为17968项和5820位。整体来看,全球生物医药技术处于成长期。
图表1:全球生物医药行业技术周期
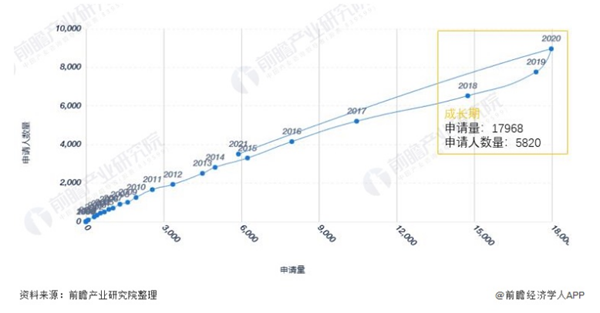
注:当前技术领域生命周期所处阶段通过专利申请量与专利申请人数量随时间的推移而变化来分析。
全球生物医药行业专利申请量及专利授权量
2010-2020年全球生物医药行业专利申请数量呈现逐年增长态势,2020年全球生物医药行业专利申请数量为17968项。
在专利授权方面,2010-2018年全球生物医药行业专利授权数量逐年增长,2019年开始出现下降趋势,2020年全球生物医药行业专利授权数量为5820项,授权比重为32.39%。
2021年1-10月,全球生物医药行业专利申请数量和专利授权数量分别为5890项和334项,授权比重为5.67%。截止2021年10月14日,全球生物医药行业专利申请数量10.5万项。


从学术到产业,更多定制化产业周刊(全球产业舆情监测、前沿技术情报追踪、产融政策权威解读、产业招商精准线索),敬请拨打400-068-7188。同时前瞻产业研究院还提供产业大数据、产业研究、产业链咨询、产业图谱、产业规划、园区规划、产业招商引资、IPO募投可研、IPO业务与技术撰写、IPO工作底稿咨询等解决方案。
品牌、内容合作请点这里:寻求合作 ››


 让您成为更懂趋势的人
让您成为更懂趋势的人
想看更多前瞻的文章?扫描右侧二维码,还可以获得以下福利:

下载APP

关注微信号


扫一扫下载APP
与资深行业研究员/经济学家互动交流让您成为更懂趋势的人
违法和不良信息举报电话:400-068-7188 举报邮箱:service@qianzhan.com 在线反馈/投诉 中国互联网联合辟谣平台
Copyright © 1998-2026 深圳前瞻资讯股份有限公司 All rights reserved. 粤ICP备11021828号-2 增值电信业务经营许可证:粤B2-20130734